Periodos de la tabla periódica
Periodos de la tabla periódica
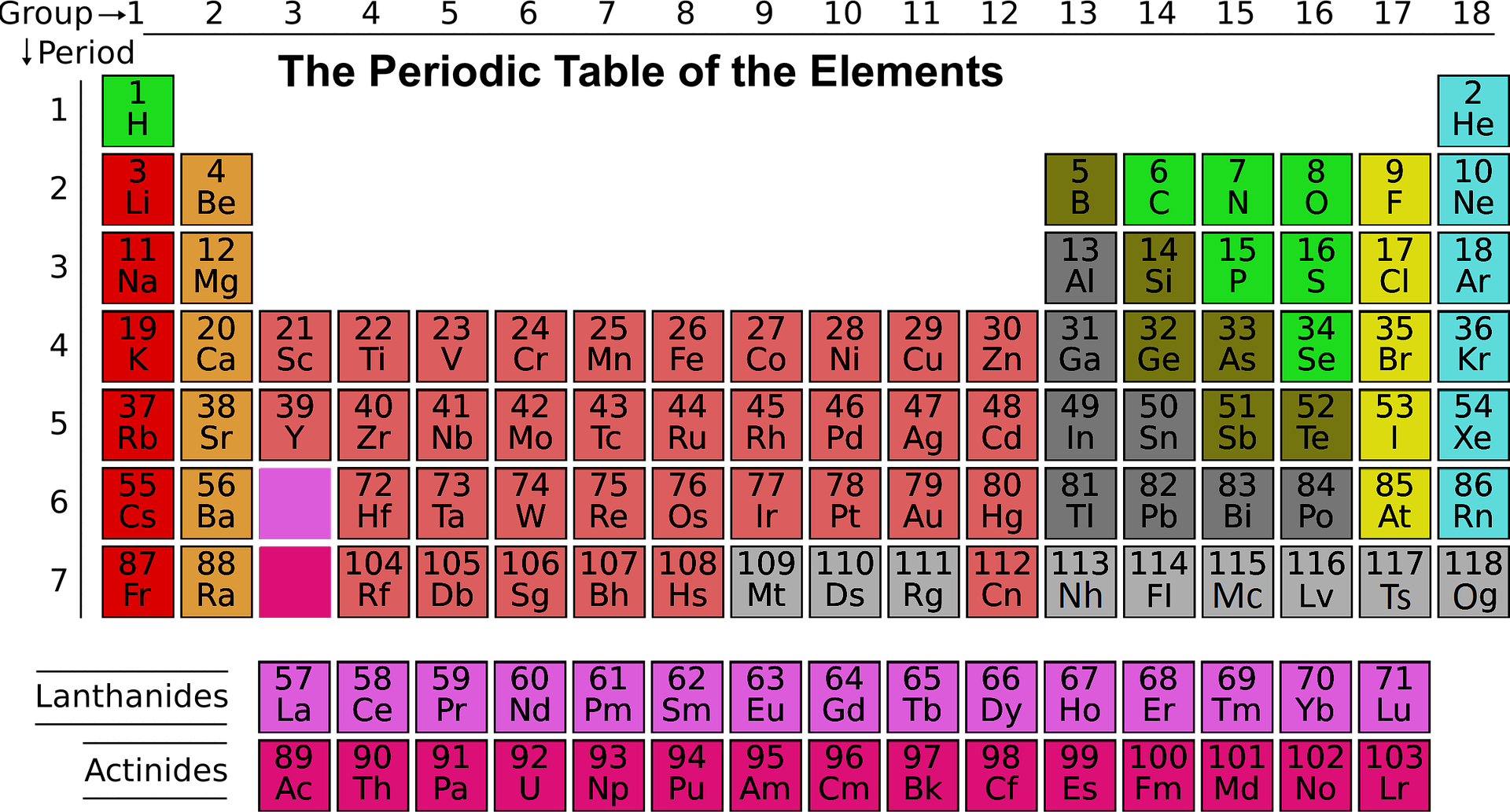
Con el nombre de período, la Química distingue cada una de las siete líneas horizontales, mostradas de arriba a abajo, que componen la Tabla Periódica. También están numeradas del 1 al 7, lo que no sólo es así en su orden correlativo, sino también porque el número de cada uno de los períodos indica el número del nivel de energía principal que los electrones de los elementos, pertenecientes a un período específico, comienzan a llenar. Según la distribución actual y la conformación de este cuadro de clasificación química, se pueden encontrar siete tipos diferentes de períodos, que se detallarán a continuación:
Período 1
Elementos del Período 1: Un elemento pertenece al Período 1 cuando se encuentra en la primera fila de la Tabla Periódica .
El período 1 indica que el átomo tiene electrones en un solo nivel de energía.
Los elementos que pertenecen al Período 1 son
– Hidrógeno (Z=1): tiene características similares a los elementos alcalinos, por lo que se incluye en ese grupo.
– Helio (Z=2): siguiendo el mismo criterio que los otros elementos, iría en la segunda columna, pero como se comporta como un gas noble al tener su última órbita completa, se incluye en la columna de gases nobles.
Período 2
Un elemento pertenece al período 2 cuando se encuentra en la segunda fila de la tabla periódica.
El período 2 indica que el átomo tiene electrones distribuidos en dos niveles de energía.
Hay 8 elementos pertenecientes al Período 2 son:
– Litio (Z=3): perteneciente al Grupo IA, es un metal alcalino blando que se oxida fácilmente en el agua o el aire.
– Berilio (Z=4): pertenece al Grupo IIA, es un metal alcalino terrestre, ligero y duro pero a la vez es también quebradizo.
– Boro (Z=5): pertenece al Grupo IIIA, es un metaloide de aspecto negruzco que tiene propiedades semiconductoras.
– Carbono (Z=6): pertenece al Grupo IVA, es un no-metálico con apariencia y propiedades variables según sus átomos a nivel molecular.
– Nitrógeno (Z=7): pertenece al Grupo VA, es un no-metálico con alta electronegatividad y se encuentra en forma de gas a temperatura ambiente
– Oxígeno (Z=8): pertenece al Grupo VIA, es un no-metal que está en forma de gas a temperatura ambiente
– El flúor (Z=9): pertenece al Grupo VIIA, es un halógeno, es el elemento más electronegativo y se encuentra en forma de gas a temperatura ambiente
– Neón (Z=10): pertenece al Grupo VIIIA, es un gas noble ya que tiene su última capa completa de electrones.
Período 3
Un elemento pertenece al Período 3 cuando se encuentra en la 3ª fila de la Tabla Periódica .
El período 3 indica que el átomo tiene electrones distribuidos en tres niveles de energía.
Hay 8 elementos pertenecientes al Período 3 son:
– Sodio (Z=11), Magnesio (Z=12), Aluminio (Z=13), Silicio (Z=14) , Fósforo , Z=15), Azufre (Z=16), Cloro (Z=17), Argón (Z=18)
Período 4
Un elemento pertenece al período 4 cuando se encuentra en la 4ª fila de la tabla periódica.
El período 4 indica que el átomo tiene electrones distribuidos en cuatro niveles de energía.
Hay 18 elementos pertenecientes al período 4:
– Potasio (Z=19), Calcio (Z=20), Escandio (Z=21), Titanio (Z=22), Vanadio (Z=23), Cromo (Z=24), Manganeso (Z=25), Hierro (Z=26), Cobalto (Z=27) Níquel (Z=28), Cobre (Z=29), Zinc (Z=30), Galio (Z=31), Germanio (Z=32), Arsénico (Z=33), Selenio (Z=34), Bromo (Z=35), Criptón (Z=36)
Período 5
Un elemento pertenece al período 5 cuando se encuentra en la 5ª fila de la tabla periódica.
El período 5 indica que el átomo tiene electrones distribuidos en cinco niveles de energía.
Hay 18 elementos pertenecientes al período 5:
– Rubidio, Estroncio, Yttrio, Circonio, Niobio, Molibdeno, Tecnecio, Rutenio, Rodio, Paladio, Plata, Cadmio, Indio, Estaño, Antimonio, Telurio, Yodo, Xenón…
Período 6
Elementos del período 6:
Un elemento pertenece al Período 6 cuando se encuentra en la 6ª fila de la Tabla Periódica.
El período 6 indica que el átomo tiene electrones distribuidos en seis niveles de energía.
En total, los elementos que componen el Período 6 son los siguientes: Cesio (Cs), Bario (Ba), Hafnio (Hf), Tántalo (Ta), Tungsteno (W), Renio (Re), Osmio (Os), Iridio (Ir), Platino (Pt), Oro (Au), Mercurio (Hg), Talio (Tl), Plomo (Pb), Bismuto (Bi), Polonio (Po), Astano (At), Radón (Rn). También en este período se tienen en cuenta los elementos Lantánidos: Lantano (La), Cerio (Ce), Praseodimio (Pr), Neodimio (Nd), Prometeo (Pm), Samario (Sm), Europio (Eu), Gadolinio (Gd), Terbio (Tb), Disprosio (Dy), Holmio (Ho), Erbio (Er), Tulio (Tm), Ytterbio (Yb), Lutecio (Lu).
Período 7
Un elemento pertenece al período 7 cuando se encuentra en la 7ª fila de la tabla periódica.
El período 7 indica que el átomo tiene electrones distribuidos en seis niveles de energía.
Los elementos que componen este período son los siguientes: Francio (Fr), Radio (Ra), Rutherfodio (Rf), Dubnio (Db), Seaborgio (Sg), Bohrio (Bh), Hassio (Hs), Meitnerio (Mt), Darmstadio (Ds), Roentgenio (Rg), Flerovio (Fl), Ununpetio (Uup), Livermorio (Lv), Ununseptio (Uus), Ununoctio (Uuo). También en este período son los actínidos Fermio (Fm), Mendelevio (Md), Nobelio (No) y Lawrencio (Lr).
Características del cuadro periódico
La tabla periódica es una plataforma creada para hacer un seguimiento de los elementos químicos que han sido descubiertos e identificados hasta ahora.
Esta clasificación fue iniciada y diseñada por Dimitri Mendeleyev, quien catalogó en una tabla los elementos que existían identificados en su época, exponiéndolos de la manera más adecuada y sencilla posible.
Debido al descubrimiento de nuevos elementos y a la necesidad de clasificarlos, otros científicos como Alfred Wenner modificaron y mejoraron la tabla iniciada por Mendeleyev, añadiendo los elementos y distinciones diversas que integran las características de la actual tabla periódica.
Las características de la tabla periódica son las siguientes:
La tabla periódica se divide en:
-
- Metales alcalinos.
- Metales alcalinotérreos.
- Metales de transición.
- Grupo del boro.
- Grupo del carbono.
- Grupo del nitrógeno
- Chalkogenes.
- Halógenos.
- Gases Nobles.
- Lantánidos o tierras raras.
- Actínidos.
- El orden de la tabla periódica se hace por «períodos», estos períodos son las filas de la tabla periódica.
- Estos grupos están formados por los elementos que tienen similitud entre ellos.
- El número, o número atómico, es el número que se añade a cada elemento y se ordena según el número de protones que contiene cada elemento.
- Es el nombre que se establece a partir de los protones y neutrones del núcleo de cada elemento.
- Los colores se utilizan para separar los tipos de elementos que existen y son amarillo, naranja, verde, azul, rojo, púrpura y lila.
- Son el número o cantidad de electrones que contiene un átomo a nivel energético.
¿Cómo están representados los elementos químicos?
La mayoría de los elementos están representados por su símbolo químico, que es la primera o dos letras de su nombre. Son la forma abreviada de los nombres de los elementos químicos. Esto hace que sea mucho más fácil para los químicos trabajar cuando están escribiendo las fórmulas de los compuestos.
La primera letra está siempre en mayúsculas. Por ejemplo: para el hidrógeno es H, para el oxígeno es O y para el calcio es Ca. Ne es para el neón y Se es el selenio.
Algunos símbolos de los elementos provienen de palabras de origen griego, alemán o latino. Ejemplos:
- Mercurio es Hg del griego hydragyrum que significa «agua de plata».
- El oro es Au del latín aurum.
- Un elemento cuyo símbolo deriva del árabe es el potasio o K, del kalium que significa «álcali».
Contenido





