Electrones de valencia
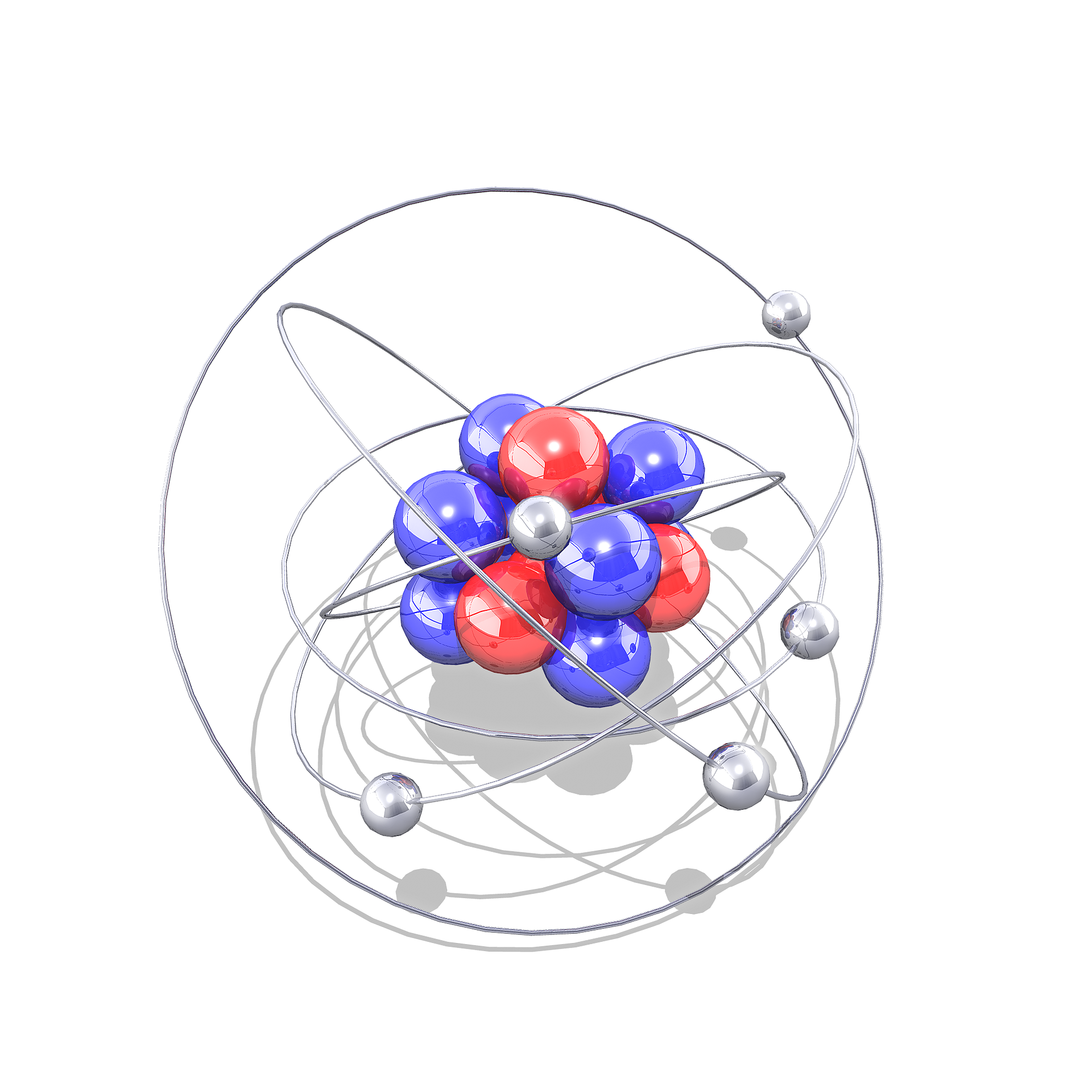
Electrones de valencia
Son los electrones que están en la última capa electrónica (llamados orbitales de valencia) y tienen una alta posibilidad de participar en una reacción química. Estos electrones tienen el mayor número cuántico n principal. Son de vital importancia en la formación de moléculas y compuestos, ya que determinan la capacidad del átomo para formar enlaces. Cuando un elemento se une a otro lo hace a través de sus electrones de valencia.
También se puede decir que estos electrones son los más alejados del núcleo del átomo, y por lo tanto los que comúnmente pueden participar en la formación de enlaces químicos.
Propiedades y características de los Electrones de valencia
Estos electrones de valencia son decisivos en la reactividad de un elemento, ya que determinan la facilidad con la que los elementos se unen con otros para formar un nuevo compuesto en cuestión.
Si observamos la capa de valencia de un gas noble, veremos que está completamente llena, entonces, este átomo no tiende a ganar o perder electrones. Por esta razón se dice que los gases nobles no reaccionan en condiciones normales, es decir, son inertes. Generalmente, los elementos de los Grupos 1, 2 y 13 a 17 tienden a reaccionar para obtener una configuración electrónica similar a la del gas noble más cercano, cuya configuración electrónica es ns2 np6.
Por ejemplo, los metales más reactivos, como los de los Grupos 1 y 2 necesitan perder sólo uno o dos electrones de valencia para formar cationes, y así obtener una configuración electrónica del gas noble más cercano. Los no metales tienden a atraer electrones de valencia adicionales para formar enlaces iónicos o covalentes.
Los no-metales más reactivos son los halógenos (elementos del grupo 7), como el flúor y el cloro. Ambos tienen una configuración muy parecida a la del gas noble y sólo necesitan un electrón de valencia para completar su octeto, por lo que los halógenos tienden a aceptar ese electrón de los metales alcalinos.
Tabla periódica con valencias
En la tabla periódica los elementos se organizan según sus propiedades químicas y físicas de los elementos en función de su número atómico. En la siguiente tabla se puede ver la valencia química de algunos elementos, no es necesario aprenderlos todos. Sólo los más básicos, como la valencia del carbono, oxígeno, nitrógeno, azufre, boro, cloro, los del grupo uno y dos, ya que éstos se utilizan normalmente como base para el estudio de los enlaces químicos.
Hay dieciocho columnas verticales llamadas Grupos y siete filas horizontales llamadas Períodos. Todos los elementos de un grupo tienen el mismo número de electrones de valencia (esto no ocurre en los metales de transición). Los electrones de valencia aumentan en número a medida que se avanza en un período. Luego, a medida que comienza el nuevo período, el número disminuye a uno y comienza a aumentar nuevamente.
Por ejemplo, cuando en la tabla periódica pasamos del carbono al nitrógeno, y luego al oxígeno, el número de electrones de valencia aumenta de 4 a 5 y luego a 6. Cuando pasamos del flúor al neón y luego al sodio, el número de electrones de valencia aumenta de 7 a 8 y luego disminuye a 1 cuando empezamos con el período del sodio.
Utilidad de los Electrones de valencia
Cuando los átomos forman enlaces, lo hacen sólo a través de sus electrones más externos, los del último nivel de energía, llamados electrones de valencia. Los electrones de valencia son aquellos que permiten la reacción de un átomo con otro, ya sea del mismo elemento o de elementos diferentes, ya que tienen la facilidad o predisposición de participar en los enlaces
Algunas valencias de los elementos químicos:
- Número del valor del carbono: 4
- Valor del oxígeno: 6
- Número de valencia del nitrógeno: 5
- Número de valencia del azufre: 6
- Número de valencia del Cloro: 7
- Número de valencia del Fósforo: 5
Contenido




