Electrón
¿Qué es un electrón?
El tamaño de un electrón es 1836 veces menor que el de los protones (contribuyen con el 0,06% de la masa total de un átomo), y como no tienen subestructuras ni divisiones, se consideran una partícula fundamental de la materia.
Los electrones desempeñan un papel esencial en ciertas fuerzas físicas y fenómenos de la naturaleza, como la electricidad, el magnetismo o la conductividad térmica, y en gran medida determinan los enlaces atómicos, tanto iónicos (pérdida o ganancia de electrones) como covalentes (uso conjunto de electrones). Cuando están en movimiento, los electrones generan campos eléctricos, que pueden afectar a las partículas que los rodean.
El origen de los electrones, según la teoría más aceptada sobre el origen del universo, señala que se formaron durante los primeros milisegundos del llamado Big Bang, cuyas temperaturas superaron los 1010 K, lo suficiente como para formar pares de positrones (e+) – electrones (e-) que se aniquilaron entre sí al tener una carga eléctrica opuesta.
Por razones desconocidas, el número de estos últimos era mucho mayor que el de sus opuestos, y fueron capaces de sobrevivir y comenzar a ser atraídos por los primeros protones cuando el universo se había enfriado lo suficiente, formando así los átomos más elementales de la naturaleza.
La cantidad de electrones en los átomos de la materia determina que ésta tenga una carga neutra (equilibrio entre protones y electrones), positiva (escasez de electrones) o negativa (exceso de electrones).
Al mismo tiempo, hay electrones «libres» que pueden moverse de un átomo a otro en la materia, generando así flujos eléctricos o campos magnéticos, dependiendo de la temperatura a la que se encuentren. Esto permite la creación de electricidad, utilizando materiales con un campo magnético variable, que se conocen como materiales conductores.
Masa del electrón
Investigadores alemanes han determinado que la masa atómica del electrón es de 0,000548579909067 (unos 9,109 x 10-28 gramos), una cifra 13 veces más precisa que la registrada hasta ahora. El nuevo valor permitirá profundizar en el modelo estándar de la física y estudiar lo que puede estar más allá de él.
Carga del electrón
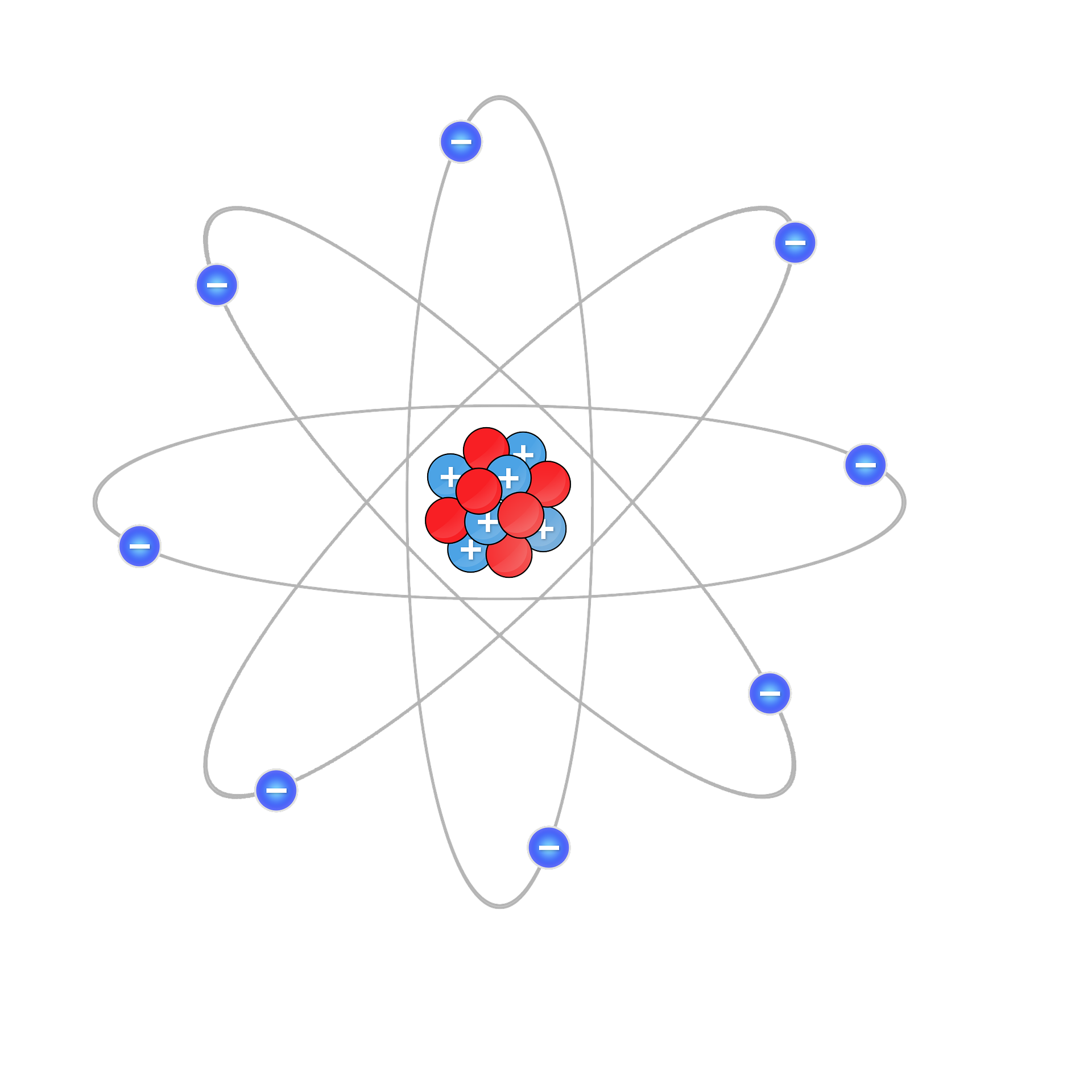
Los átomos están formados por un núcleo y una envoltura (órbitas). En el núcleo, los protones y los neutrones están muy firmemente unidos. Los protones tienen una carga positiva y los neutrones no tienen carga. Alrededor del núcleo están las órbitas donde los electrones giran sobre ellos. Los electrones tienen una carga negativa.
Ambas cargas, la de los protones (positiva) y la de los electrones (negativa), son las mismas, pero en signos opuestos.
La carga eléctrica elemental es la del electrón. El electrón es la partícula elemental que lleva la menor carga eléctrica negativa que se puede aislar. Como la carga de un electrón es extremadamente pequeña, el Culombio, que equivale a 6,24 10E18 electrones, se toma en el S.I. (Sistema Internacional) por la unidad de carga eléctrica.
Características de un electrón
Los electrones pertenecen a la primera generación de partículas fundamentales.
Los electrones pertenecen a un tipo de partículas fundamentales llamadas leptones, que serían las partículas mínimas que componen toda la materia, incluyendo protones y neutrones.
Así, los electrones son los leptones menos cargados del conjunto, y pertenecen a la primera generación de partículas fundamentales (la segunda generación está formada por las partículas muón y tau).
La masa de un electrón es siempre de 9.019 x 10-31 kg y su respectiva carga eléctrica es de -1602 x 10-19 culombios, lo que representa una carga idéntica a la del protón, pero de signo opuesto. Esta medida se conoce como la carga elemental de la naturaleza.
¿Quién descubrió el electrón?
El electrón fue descubierto a finales del siglo XIX, gracias a sucesivas investigaciones en el campo de los rayos catódicos, en las que se descubrió que en lugar de ondas de energía, eran partículas cargadas electronegativas, inicialmente llamadas corpúsculos, que tenían una milésima parte de la masa del ión hidrógeno, el menos masivo de todos. Lo curioso es que al variar la naturaleza del gas utilizado, estas partículas conservaban todas sus características.
Más tarde, el irlandés George Francis Fitzgerald las bautizó con el nombre de «electrones», nombre que desde el principio tuvo una aceptación general. La pertenencia de estas partículas a la estructura del átomo fue postulada hacia 1914, gracias a los experimentos de Rutherford, Moseley, Franck y Hertz, y al modelo atómico propuesto anteriormente por Niels Bohr.
Contenido